背景
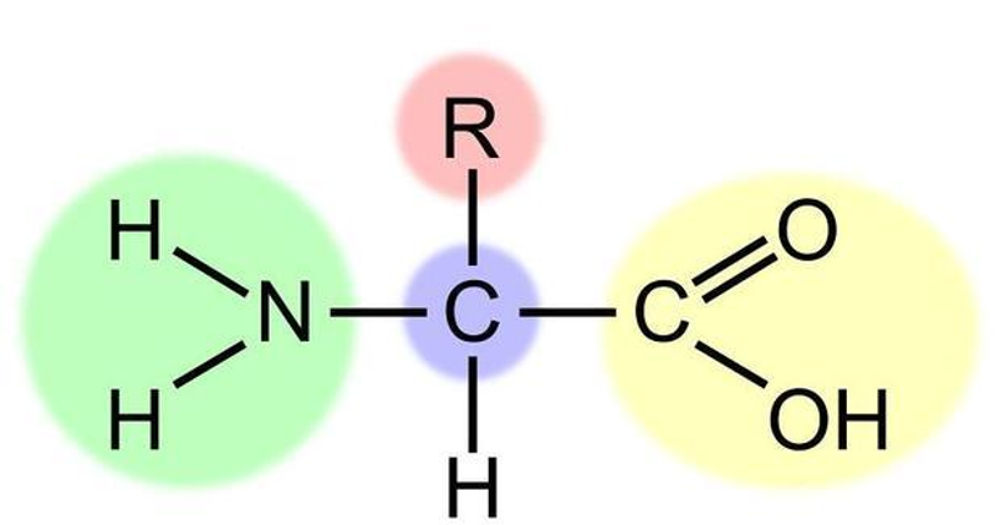
对于单个氨基酸,其α-碳原子通过σ键连接左右的羰基和氨基,不考虑空间位阻和多样的残基等问题,一个蛋白质单就骨架就有许多能够自由旋转的键,因而也存在着无数多种可能的构象。但是就现实而言,每个蛋白具有结构或者功能上的特殊性,反过来暗示我们每个蛋白质应当具有唯一的结构,或是在几种特定的构象下分布。在1980年代,科学家们得到了几种重要蛋白质的结晶,其中包括但不限于血红蛋白、脲酶。能够形成晶体这一事实也证明了:即使是像脲酶(48.3kDa)这么大的蛋白质也具有唯一的结构。解决了蛋白结构唯一性是否存在的问题,对于理解蛋白质功能的构建至关重要的。
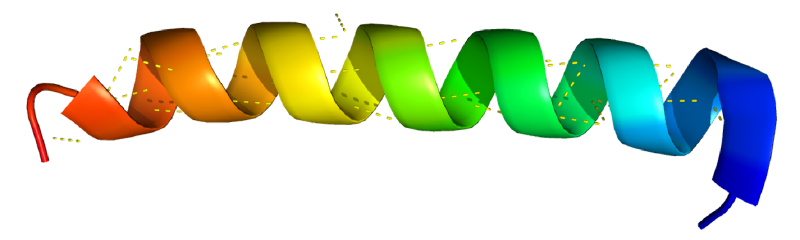
α螺旋是什么
多肽链中的肽链可能的最简单排布是一个螺旋结构,Pualing和Corey在1950年称之为alpha螺旋。在这种结构中,多肽骨架围绕一个假想的中轴螺旋延伸,氨基酸残基向外突出,每个螺旋包含3.6个氨基酸,按照轴线延伸0.54nm。自然界中已发现的α螺旋都是右手螺旋。

之所以α螺旋比其他可能的构象更为稳定,是因为α螺旋最充分利用了肽键彼此形成的内部氢键,一个螺旋中第n个位置的肽键中与电负性氮原子连接的氢原子,与第n+4个肽键中的羰基氧形成氢键,稳定了α螺旋。
而每个氨基酸的侧链也会影响α螺旋的稳定性,氨基酸可以通过残基的性质划分为亲水性和疏水性两类。亲水性氨基酸比如天冬氨酸(D)、赖氨酸(K)等残基中往往包含着羧基、氨基等强极性基团,疏水性氨基酸比如亮氨酸(L)、苯丙氨酸(F)等则带有脂肪链和芳香环。
因具有不同的残基,氨基酸被划分为不同的类别,但是在电子密度图谱中,一些氨基酸体现出了特别的相似性2。而对蛋白质的分子结构成像,证明了所有的20种天然氨基酸都存在于α螺旋中,没有因亲水或疏水而舍弃部分。
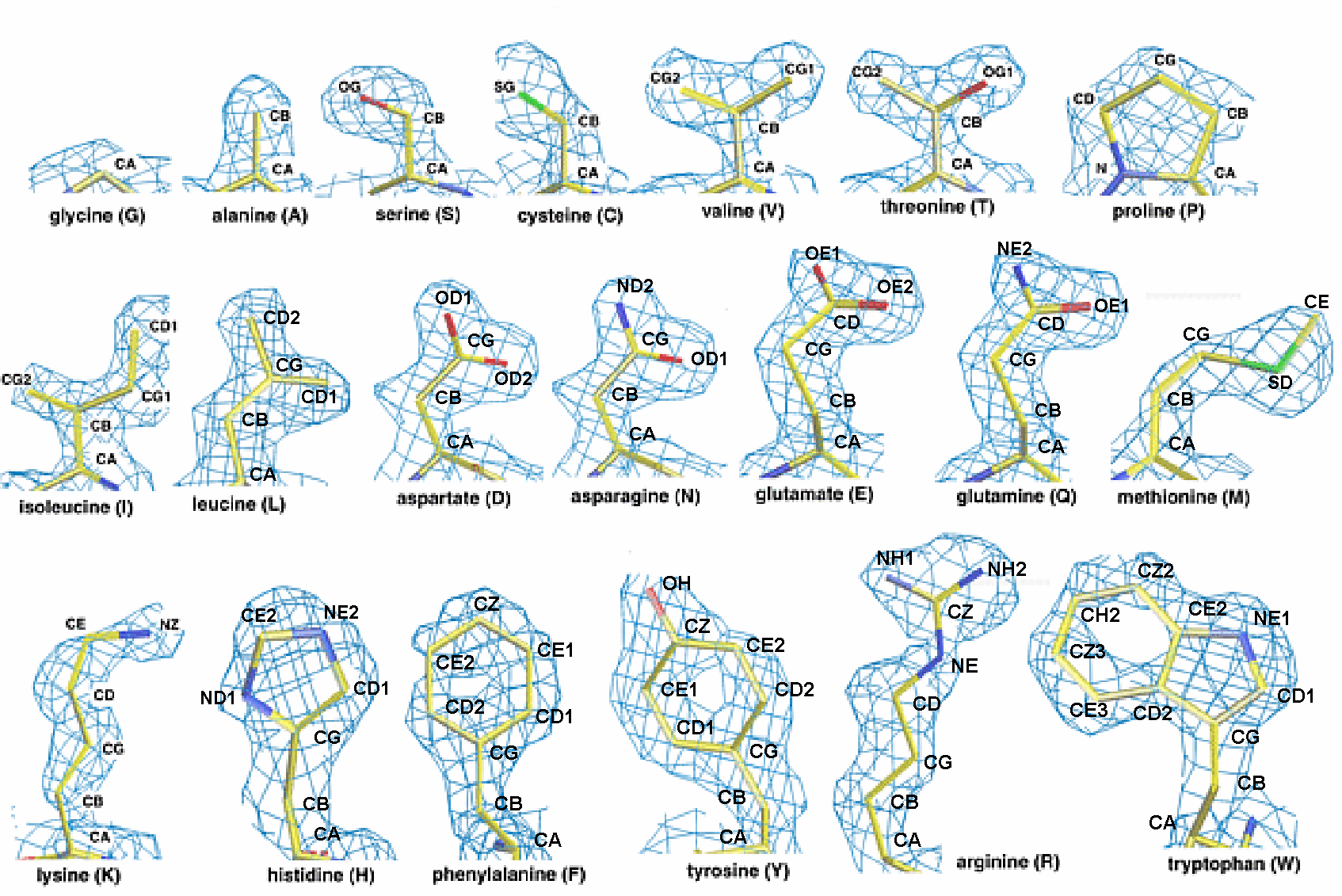
怎么形成α螺旋
正如上文所提及,亲水性的氨基酸和疏水性的氨基酸都有参与到α螺旋的形成当中,但是这不代表所有的氨基酸序列都能够形成稳定的α螺旋。
比如如果氨基酸含有一段连续的谷氨酸,在中性的环境下,谷氨酸残基中的羧基将失去氢原子,相邻谷氨酸的带电羧基相互强烈排斥,无法形成α螺旋。同样的中性条件下,连续的赖氨酸、精氨酸也会因为正电基团而互相排斥,无法形成α螺旋。
与之相对应的,正电基团与负电基团之间的互相作用也能够稳定α螺旋。类似肽键间的排布规律,第n个位置的氨基酸残基可以与第n+4个氨基酸残基通过正负电形成离子对。有些时候两个芳香族氨基酸也会这样分布,通过疏水相互作用稳定α螺旋。
对于一个α螺旋的稳定形成,一般要考虑以下五种约束:
- 连续的带电氨基酸残基之间的静电排斥力或者吸引力。
- 相邻氨基酸残基之间的空间位阻。
- n与n+3/n+4位氨基酸残基之间的相互作用。
- 脯氨酸或者甘氨酸的存在。
- α螺旋两端氨基酸残基与电偶的相互作用。
https://baike.baidu.com/item/%E6%B0%A8%E5%9F%BA%E9%85%B8/303574 ↩︎
https://www.cambridge.org/core/journals/quarterly-reviews-of-biophysics/article/hiding-in-plain-sight-three-chemically-distinct-helix-types/55EB6C1845791F987565FC5BE93715C4 ↩︎
https://people.mbi.ucla.edu/sawaya/m230d/Modelbuilding/modelbuilding.html ↩︎